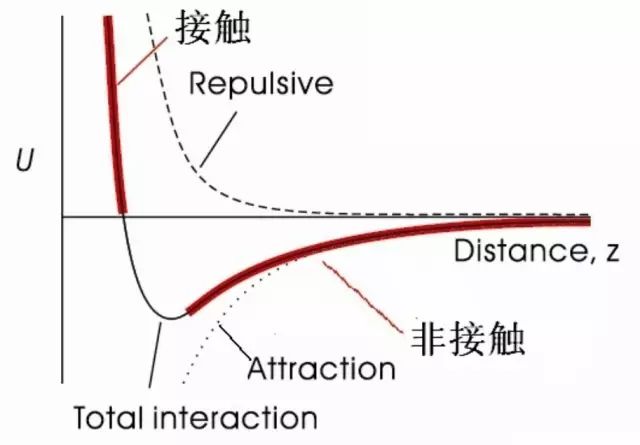
摘要:
本文旨在全面解析Cre/Loxp及相关重组酶系统,从基本原理到实际应用进行深入探讨。我们将介绍Cre/Loxp系统的基本原理和构成;分析其在基因工程、基因疗法和转基因动物制备等领域的应用;最后,探讨其他相关重组酶系统及其与Cre/Loxp系统的关联。
一、引言
Cre/Loxp系统是一种广泛应用于基因工程、基因疗法和转基因动物制备等领域的重组酶系统。
该系统基于细菌中发现的重组酶Cre(Cyclization recombinase)和与之相关的DNA序列Loxp(locus of crossover point)进行设计。
下面我们将详细介绍这一系统的原理、构成及其在各个领域的应用。
二、Cre/Loxp系统的原理与构成
1. 原理
Cre/Loxp系统是基于位点特异性重组的DNA技术。
在该系统中,Loxp是一个DNA序列,它可以作为重组酶的识别位点。
当存在重组酶Cre时,带有Loxp位点的DNA序列可以在Cre的作用下发生交换,从而实现特定DNA片段的删除、替换或重组。
2. 构成
Cre/Loxp系统主要由两部分构成:重组酶Cre和识别序列Loxp。
Loxp序列包括两个13bp的倒置重复序列和一个8bp的间隔区。
当两个Loxp序列方向相同且被足够长度的DNA序列分隔时,它们可被重组酶Cre所识别,进而发生DNA重组。
三、Cre/Loxp系统在基因工程中的应用
1. 基因敲除
通过Cre/Loxp系统,科学家可以在特定的基因位点引入Loxp序列,然后通过表达Cre重组酶实现对该位点的精确敲除。
这种方法具有高度的特异性和准确性,已成为基因功能研究的重要工具。
2. 基因疗法
在基因疗法领域,Cre/Loxp系统可用于精确地修复基因突变或替换异常基因。
通过将正常的基因携带到患者体内并表达Cre重组酶,可以实现对异常基因的敲除和替换,从而达到治疗疾病的目的。
四、Cre/Loxp系统在转基因动物制备中的应用
利用Cre/Loxp系统,科学家可以在转基因动物的特定细胞或组织中实现基因敲除或激活。
这种方法有助于研究特定基因在动物生长发育过程中的功能,为疾病研究和药物开发提供重要的实验模型。
五、其他相关重组酶系统及其与Cre/Loxp系统的关联
除了Cre/Loxp系统外,还有其他重组酶系统如Flp/FRT、Dre/DREADLOCK等。
这些系统具有类似的原理,都是通过重组酶识别特定的DNA序列并实现DNA重组。
这些系统之间存在一定的关联性,可以相互补充,为基因工程提供更为丰富的工具。
六、结论
Cre/Loxp系统是一种强大的工具,广泛应用于基因工程、基因疗法和转基因动物制备等领域。
通过深入了解其原理、构成及其在各个领域的应用,我们可以更好地利用这一技术为科学研究和社会发展做出贡献。
同时,其他相关重组酶系统的研究和发展也为基因工程提供了更为丰富的工具,未来值得我们进一步探索和挖掘。
shrna敲低原理
siRNA序列是与mRNA目的序列完全互补结合的,所以是降解;当不完全互补时才是抑制翻译,miRNA大部分是这样的。
从而在1oxP 动物的一定发育阶段和一定组织细胞中实现对特定基因进行遗传修饰之目的的基因敲除技术。
人们可以通过对诱导剂给予时间的预先设计的方式来对动物基因突变的时空特异性进行人为控制、以避免出现死胎或动物出生后不久即死亡的现象。 常见的几种诱导性类型如下:四环素诱导型;干扰素诱导型;激素诱导型;腺病毒介导型。
原理方法:
1、利用基因同源重组进行基因敲除基因敲除是80年代后半期应用DNA同源重组原理发展起来的。 80年代初,胚胎干细胞(ES细胞)分离和体外培养的成功奠定了基因敲除的技术基础。
1985年,首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。 到1987年,Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型。 直到现在,运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的使用方法。
2、诱导性基因敲除也是以Cre/loxp 系统为基础,但却是利用控制Cre 表达的启动子的活性或所表达的Cre 酶活性具有可诱导的特点,通过对诱导剂给予时间的控制或利用Cre基因定位表达系统中载体的宿主细胞特异性和将该表达系统转移到动物体内的过程在时间上的可控性。
基因敲除小鼠模型必须先得到纯合子吗
基因敲除小鼠模型必须先得到纯合子小鼠和大鼠可谓是生命科学实验室里的明星,成功的小鼠和大鼠模型可谓是生命科学的好帮手.很多人可能想自己设计或是了解条件性基因敲除小鼠,在此做个小结,供大家参考.条件性基因敲除小鼠的设计利用了Cre/LoxP或Flipe/Frt原理.它们都是位点特异性重组酶系统.这里以Cre/LoxP系统为例.比如在待敲除的一段目标DNA序列的两端各放置一个loxP序列,得到flox(flanked by loxP)小鼠.将flox小鼠与带有细胞特异性表达Cre的小鼠交配繁殖,以获得在特定细胞里把目标基因敲除掉的小鼠,即条件性基因敲除小鼠.此外,若与控制Cre表达的其他诱导系统(比如CreERT2)相结合,还可以对某一基因同时实现时空两方面的调控/loxP系统来源于噬菌体,可以介导位点特异的DNA重组.该系统含有两个组成成分:一个是一段长34bp的DNA序列(LoxP序列),含有两个13 bp的反向重复序列和一个8 bp的核心序列的方向由中间这8个碱基决定.这段LoxP序列是Cre重组酶识别的位点.令一个组成部分是Cre重组酶.它是由噬菌体编码的一种由343个氨基酸组成的蛋白可以介导两个LoxP位点的重组,从而引起两个LoxP之间DNA序列的缺失.如果将Cre重组酶cDNA通过基因工程的手段置于组织或细胞特异性启动子之下,可以得到Cre组织/细胞特异性表达的Cre小鼠,也叫Cre工具小鼠.跟Flox小鼠交配之后,可以得到条件性基因敲除小鼠.所谓Flox小鼠是指在某个基因的某个外显子两侧各放一个LoxP序列.这段序列就是Flanked by LoxP,也就叫做Flox小鼠.这种Flox小鼠一般要通过设计构建打靶载体、胚胎干细胞重组、囊胚显微注射、和嵌合体小鼠传代来获得.这种小鼠跟Cre工具小鼠交配,由于Cre的表达,介导两个LoxP位点序列的重组,从而敲除两个LoxP之间的序列.由于不同Cre工具小鼠的Cre表达有组织/细胞特异性,就可以达到在不同组织、细胞里特异性敲除目的基因的目标.比如上皮细胞、胸腺细胞、T细胞、B细胞、心肌细胞、肠道、肺脏等.那如何设计条件性基因敲除小鼠呢?这里所说的设计主要是Flox小鼠的设计.所谓条件性敲除,是说除了特定细胞外,其它细胞里面没有任何的基因表达异常.一般情况下,不要在第一个外显子前面放置LoxP序列.因为第一个外显子前面一般是启动子.放置LoxP序列有可能会破坏或改变启动子活性.条件性敲除一般是敲掉最早引起移码突变的外显子.这样的话,最好不要敲除有起始密码子ATG的外显子.否则的话,基因可能会利用ORF内的ATG编码一个缺少部分N端序列的蛋白,这个蛋白很可能有全部或部分野生蛋白的功能.在选择要敲除的外显子的时候(各放一个LoxP在一个外显子的两侧),该外显子的碱基数目不能是3N,否则新基因pre-RNA拼接得到的mRNA不能产生移码突变.会产生一个与野生蛋白相比少了一段中间序列的新蛋白.如果一个外显子的碱基数目是3N+1或3N+2,敲除这个外显子之后会产生移码突变,就可以达到基因敲除的目的.筛选要敲除(Floxed)的外显子的时候,一般是从最上游的外显子开始筛选适合敲除的外显子.需要注意的是,一般的dna分析软件不能确定内含子和外显子的边界,需要仔细核对.95%以上的边界遵循gt/ag边界原则.也可以在Ensembl上查一个基因的外显子和内含子.这个网站上的结果绝大部分是正确的.但也需要仔细核对.毕竟基因敲除小鼠研发是一个时间比较长的过程,需要特别小心.前期做多少的考虑都不嫌多.这些原则只是对一般课题的考虑.特殊情况需要特殊处理.
什么是Meselson Radding重组模型?
基因靶位操作的原理与策略汪亚平 朱作言The Principle and Strategy of Gene TargetingWANG Ya-Ping ZHU Zuo-Yan(Institute of Hydrobiology,The Chinese Academy of Sciences,Wuhan)基因靶位操作(gene targeting)是80年代发展起来的一项重要分子生物学技术, 是通过外源DNA与染色体DNA间的同源重组,定点修饰、改造基因组特定位点的技术。 1 同源重组同源重组是基因靶位操作技术的分子生物学基础。 DNA同源重组在基因转化和遗传多样性发生中具有重要作用,受到了众多研究者的重视。 从60年代开始,在真菌系统中对同源重组机制进行了系统研究〔1〕,相继提出了多个同源重组模型。 1.1 Holliday 模型〔2〕Holliday等60年代提出的模型是第一个被普遍接受的同源重组模型,该模型以杂合DNA链的形成和随后的DNA修复解释真菌中的基因转化现象,从而建立了同源DNA顺序间遗传信息交换的基本概念。 Holliday模型中的基本要素,如Holliday结构和交叉平移等对以后的许多同源重组模型产生重要影响。 Potter等〔3〕对DNA重组的电镜观察结果,为该模型的Holliday结构提供了直接证据。 1.2 Meselson-Radding 模型〔4〕Meselson和Radding 在Holliday模型的基础上作了一些改进,认为DNA单链的形成及其向相邻DNA双链的侵入为非对称产生,提出Meselson-Radding 模型。 DNA单链形成可在一条DNA双链中首先产生,随着缺刻处DNA链的修复合成,游离出的单链末端侵入相邻DNA双链中,与同源部分配对结合,被替换的DNA链形成一个逐渐增大的D-loop。 D-loop断开后产生的单链末端交叉侵入相邻DNA双链中,DNA自由末端共价连接形成Holliday结构。 Meselson-Radding模型首次将DNA合成与重组联系起来,这种DNA杂合链形成机制似乎更贴切地解释了非对称重组现象〔1〕。 1.3 双链断裂修复模型在酵母系统的重组研究中,发现载体DNA双链断裂可大大提高同源重组的效率,Holliday和Meselson-Radding模型都不能很好地解释这一现象。 基于这一发现,Szostak 等提出了双链断裂修复(DSBR)模型〔5〕。 在这一模型中,重组发生在DNA双链断裂区,断裂区的修复以对应的同源DNA链为模板,修复的断裂区实质上成为转化区域。 DNA末端共价连接,形成两个Holliday结构,每一结构都有两种解决方式,或形成交换双链,或形成非交换双链。 基因转化不需要DNA杂合链的形成和以后的改错修复过程。 DSBR模型与Meselson-Radding模型还有另一个重要区别,前者的双链断裂区是信息接受区域,后者的DNA断裂区是遗传信息的提供者。 1.4 单链退火模型1984年,Lin等提出完全不同的单链退火(SSA)模型〔6〕。 在SSA模型中,重组在DNA双链断裂处开始,在单链特异性核酸外切酶的作用下,断裂点两侧逐渐形成DNA单链区域,这一过程持续到两个断点处出现互补DNA单链。 互补DNA单链退火,非互补末端被切除,单链缺口修复连接,完成DNA重组。 SSA模型没有其它模型所需的双链DNA的识别配对过程,不形成Holliday结构作为重组的中间过渡形式。 因此,重组毫不例外地产生DNA双链交换,并丢失非退火区域单链DNA顺序。 该模型提供了理解同源重组机制的全新视角。 除上述模型外,不同研究者提出了一引起其它重组模型。 Rao等的研究发现,在RecA蛋白的参与下,单链DNA分子进入DNA双螺旋主沟,在同源区域形成稳定的三链结构〔7〕。 其它研究小组也发现过类似的三链DNA结构,认为DNA分子的三链结构可能在同源序列识别和重组中起重要作用〔8〕。 同源重组除可在DNA分子间进行外,还可在RNA分子间或RNA与DNA分子间进行。 Stuhlmann等研究发现,逆转录病毒RNA在逆转录中发生高频同源重组〔9〕,这一现象在其它RNA病毒中也被证实〔10, 11〕。 Derr等在酵母S. cerevisiae中的研究进一步发现,RNA分子可通过cDNA途径介导基因组DNA同源重组,提出RNA介导重组模型(RNA-mediated recombination)〔12〕。 RNA分子间及RNA介导的同源重组可能提供基因组变异的新途径。 2 基因靶位操作70年代后期和80年代中期,以酵母S. cerevisiae 为模式系统,建立了基因靶位操作技术的基础〔13〕。 基因靶位操作技术的建立依赖于几个重要方面的突破:外源DNA导入酵母细胞方法的建立;有效选择标记基因(如LEU2和URA3基因)的开发利用和同源重组转化子筛选系统的建立;靶位载体同源序列DNA双链断裂提高同源重组效率现象的发现。 模式研究确立了基因靶位操作的重要技术参数,并逐渐形成成熟的研究策略。 2.1 插入型载体和置换型载体基因靶位操作载体有两种类型,即插入型载体和置换型载体,区别在于载体DNA同源序列双链断裂位点的位置不同。 插入型载体的断裂位点在同源目的顺序内,选择基因可在载体的任何位置,载体与染色体靶位点进行一次交换完成同源重组,其结果是整个载体整合到染色体靶位点上(图1, A);置换型载体的断裂位点在同源目的顺序的两侧或外侧,选择基因在同源目的顺序内,载体同源目的顺序与染色体靶位进行两次交换完成同源重组,重组的结果是由载体的同源目的顺序取代染色体靶位顺序(图1, B)。 图1 基因精细突变策略(A.进退策略;B.标记交换策略)关于两种不同载体类型的同源重组效率,有研究发现插入型载体有更高的重组效率,其重组机制接近于双链断裂修复重组模型,而置换型载体的重组机制尚不清楚〔14〕。 Deng等对鼠ES细胞的Hprt位点的22个不同载体序列进行了同源重组效率比较,发现两类基因靶位操作载体并不存在重组效率上的差异〔15〕。 2.2 基因剔除和基因精细突变用传统的遗传学方法和体外生物化学方法研究基因表达调控和产物生理功能受到诸多因素的限制,基因靶位操作技术的出现,使体外突变的基因导入生物体基因组成为可能,可在细胞和生物体水平上研究基因的表达调控及其生理功能。 应用基因靶位操作技术定点改造基因组特定基因主要采用两种方式:基因剔除和基因精细突变。 2.2.1 基因剔除基因剔除是在体外进行目的基因的功能缺失突变,突变基因通过基因靶位操作方法导入染色体基因组中,剔除内源野生型基因,实现染色体靶位基因的功能缺失突变。 基因剔除主要采用两种方案:其一,在克隆的目的基因的5端和3端形成两个突变,每一突变将独立产生基因功能丧失,通过插入型载体,将突变目的基因导入染色体基因组中。 这一方法要求在目的基因两端产生有效突变,特别是3端的有效突变有较高的技术难度,突变基因产物往往保留部分功能活性,因此,基因靶位操作前要对突变的有效性进行检测。 目的突变基因和染色体靶位基因,串联的同源基因顺序可能二度重组,产生恢复突变。 由于上述原因,这类基因剔除方案现已多不采用〔16〕。 其二,将选择标记基因直接插入载体目的基因中,这一过程通常伴随目的基因顺序的部分丢失,从而产生插入和丢失突变。 载体导入靶细胞前在目的突变基因顺序两侧断开,以置换型载体方式将突变基因导入染色体基因组中。 与插入型方案比较,置换型载体方案目的基因体外突变方便,由于突变程度加剧,基因靶位操作前不需要突变的有效性检验,基因靶位操作转化子不易产生恢复突变。 2.2.2 基因精细突变基因剔除方法使基因组中特定基因产生功能缺失,是研究某一基因的基本功能、了解基因在细胞和胚胎发育过程中作用的有效方法。 然而,基因结构与基因功能之间存在复杂的结构功能联系。 如人类遗传病发生的基础多是核苷酸水平上的突变,基因剔除方法尚不能很好地研究基因精细结构方面的变化。 另外,基因剔除方法还存在一些潜在的不利因素,如滞留在基因组中的正向选择标记基因不仅会造成所在染色体区域较大范围的中断,而且它携带的启动子或 增强子也可能会使邻近基因的转录失调,产生难以预料的表型〔17〕。 在基因剔除方法的基础上,发展了多种改进策略,以满足基因精细结构研究的需要。 (1)进退策略: 进退策略由Hasty和Valancius首先提出,它包括两次同源重组过程。 第一次以插入型载体同源重组到基因组靶位点中,完成目的突变基因和标记基因的导入,在选择培养基中得到转化细胞克隆。 第二次同源重组在基因组中的目的突变基因和染色体靶位基因之间自发产生,其结果是载体骨架、标记基因和一个同源基因顺序环出,基因组中可能保留导入的目的突变基因,这一自发性同源重组过程称之为回复。 回复的频率视不同染色体靶位点而有所差异〔17〕。 回复转化子在相应选择培养基中筛选克隆。 用PCR或Southern杂交方法可检测回复转化子是否包含目的突变基因(图1, A)。 Hasty等应用进退策略,在鼠ES细胞同源异型基因族Hox-2.6基因3端引入一个翻译终止码,得到短截43个氨基酸的突变蛋白〔17〕。 Valancius等采用类似的方法,在鼠ES细胞Hprt-中插入了一个4碱基的插入突变〔18〕。 (2)标记交换策略: 1993年,Askew等提出一个新的基因组定点突变策略〔19〕,即标记交换策略。 它包括两个过程,首先,用置换型载体将选择标记基因导入基因组靶位点,在相应的选择培养基中筛选转化子细胞克隆。 第二步将目的突变基因顺序以置换型载体导入靶细胞中,在选择培养基中得到同源重组转化子,实现染色体靶位基因的定点突变,同时剔除靶位基因中原先插入的选择标记基因(图1, B)。 Askew等采用标记交换策略,在鼠ES细胞基因组非选择性基因α2异构Na, K-ATP酶基因中引入两个密码子突变和3个无表型突变〔19〕。 标记交换策略中,第一步选择基因的标记和第二步目的突变基因置换具有相对独立性,被标记的细胞系可与多种目的突变基因进行交换,因此,应用此策略可建立染色体靶位基因的多种遗传缺陷动物模型,在基因结构与功能研究中具有重要意义。 (3)Cre-loxP重组系统策略〔20〕: Gu等提出的Cre-loxP重组系统策略是进行基因组定点突变的新途径。 Cre-loxP重组系统包括Cre重组酶和loxP位点两个部分,Cre重组酶由大肠杆菌噬菌体P1的Cre基因编码,loxP位点是Cre酶作用的特异性重组位点,由两个13-bp的反向重复顺序和8-bp间隔区域构成。 Cre重组酶可切除同向重复的两个loxP位点之间的DNA片段和一个loxP位点,保留一个loxP位点〔21〕。 Cre-loxP重组系统可在哺乳类细胞和转基因鼠中介导loxP位点特异性重组〔22, 23, 24〕。 Gu等进一步提出由同源重组和位点特异性重组组成的两步重组策略,第一步,通过置换型载体进行同源重组,向基因组靶位点引入选择标记基因,并在其两侧引入两个同向排列的loxP位点。 第二步,通过Cre重组酶介导的loxP位点特异性重组,切除位于两个loxP位点之间的所有顺序,而位于其外侧的结构顺序则均被保留。 这一策略可通过位于两个位点之间或之外的结构顺序的不同设计,达到对靶位基因不同的修饰结果。 Gu等在鼠ES细胞中首次应用该策略,定点缺失突变了免疫球蛋白重链基因中的JH~Eμ顺序,并通过胚胎细胞嵌合体技术,得到该基因突变型小鼠。 Cre-loxP重组系统除介导特异性缺失功能外,还具有介导定点整合的重要特性。 已有研究证实,Cre-loxP重组系统可介导外源DNA向病毒载体中的定点整合〔25〕。 应用Cre-loxP重组系统可以精确预定DNA缺失的片段长度,并可使之在很大范围内变化。 在表达Cre重组酶的胚胎细胞中,几乎所有的loxP位点间的顺序被切除〔26〕。 另外,与其它策略相比,转化的ES细胞经历的筛选时间较短,对ES细胞的胚胎重建能力影响较小〔20〕。 基于上述特点,这一策略在研究基因顺式调控元件方面具有重要意义。 2.3 哺乳类细胞中的基因靶位操作基因靶位操作技术应用于哺乳类细胞经历了两个时期。 早期的研究着眼于外源标记基因的同源重组,最初的研究中,将两个具不同缺失突变的neo基因共转染细胞,两个不同缺限型neo 基因同源重组,形成一个野生型neo基因和一个双重突变的neo基因,并随机整合到细胞基因组中,产生G418抗性细胞克隆。 进一步的研究发现,使其中的一个转化载体线性化可大大提高G418抗性细胞克隆数目,这和在酵母基因靶位操作中看到的情形一致。 这些研究结果显示,外源DNA在哺乳类细胞中能进行高效率的同源重组〔16〕。 为进一步研究外源DNA顺序与染色体DNA顺序间的同源重组效率,将缺陷型标记基因以随机重组的方式整合到细胞染色体基因组中,如neo和HSV-tk等基因,建立基因组中可选择的标记基因靶位。 在上述转化细胞中导入该标记基因的另一类型突变顺序,在相应的选择培养基中筛选重组子克隆。 研究证实,导入细胞内的外源DNA顺序可与内源靶位DNA顺序进行同源重组,但同源重组率极低,大约在10-5~10-6之间。 另一类模型研究则以哺乳类细胞内源可选择标记基因作为定点突变的靶位。 Hprt基因是一个理想的内源标记基因,Hprt基因与X染色体连锁,在雄性胚胎来源的ES细胞中以单拷贝存在,因此,只需要单一拷贝基因突变即可获得可选择性表型。 Hprt+细胞和Hprt-细胞可分别在HAT培养基和6-TG培养基中筛选。 Doetschman等应用基因靶位操作技术,成功地修复了小鼠Hprt- 突变型ES细胞,在HAT培养基中获得Hprt+细胞,并证实野生型突变由基因同源重组所至,同源重组效率为1.4×10-6[〔30〕。 由于Hprt基因突变表型可以直接筛选,该基因被用于多种基因靶位操作模型研究〔31, 32〕。 哺乳类细胞基因靶位操作面临两大困难〔33〕。 一方面,哺乳类细胞基因组庞大(109bp以上),比酵母复杂得多,加之哺乳类细胞培养技术上的限制,哺乳类细胞中基因靶位操作成功率极低;另一方面,哺乳类细胞似乎有极强的随机整合外来DNA片段的能力,同源重组与非同源重组的比率大约为10-3~10-4 〔29, 30, 31, 34, 35〕。 因此,建立高效可行的基因靶位操作转化子筛选系统,是哺乳类细胞基因靶位操作的重要前提和技术保障。 作者单位:中国科学院水生生物研究所,武汉参考文献 1 Sedivy J M, Joyner A recombination: molecular mechanisms. in gene targeting. Oxford University Press, 1992, 23~51 2 Naldman A S. Molecular mechanisms of homologous recombination, in gene targeting. Manuel A, Ed., CRC Press, 1995, 45~64 3 Potter H, Dressler D. On the mechanism of genetic recombination: electron microscopic observation intermediates. Proc. Natl. Acad. Sci. USA, 1976, 73: 3000~3004 4 Meselson M S, Radding C M. A general model of genetic recombination. Proc. Natl. Acad. Sci. USA, 1975, 72: 358~361 5 Szostak J W, Orr-weaver T L, Rothstein R Jet double-strand break-repair model for recombination. Cell, 1983, 33: 25~35 6 Lin F-L, Sperle K, Sternberg N. Model for homologous recombination during transfer of DNA into mouse L cells: role for DNA ends in the recombination process. Mol. Cell. Biol., 1984, 4: 1020~1034 7 Rao B J, Duter C M. Stable three-stranded DNA model by RecA protein. Proc. Natl. Acad. Sci. USA, 1991, 88: 2948~2988 8 Stasiak A. Three-stranded DNA structure: is this the secret of DNA homologous recombination? Mol. Microbio., 1992, 6: 3267~3276 9 Stuhlmann H, Berg P. Homologous recombination of copackaged retrovirius RNAs during reverse transcription. J. Virol., 1992, 66: 2378~2388 10 Liao C L, Lai M M. RNA recombination in a coronavirus: recombination between viral genomic RNA and transfected RNA fragments. J. Virol., 1992, 66: 6117~6124 11 Edwards M C, Petty I T, Jackson A O. RNA recombination in the genome of barley stripe mosaic virus. Virology, 1992, 189: 389~392 12 Derr L K, Strathern J N, Garfinkel D J. RNA-mediated recombination inS. , 1991, 67: 355~364 13 Botstein D, Fink G L. Yeast: an experimental organism for modern biology. Science, 1988, 240: 1439~1443 14 Hasty P, Rivera-perez J, Bradley A. The role and fate of DNA ends for homologous recombination in embryonic stem cells. Mol. Cell. Biol., 1992, 12: 2464~2474 15 Deng C, Capecchi M R. Reexamination of gene targeting frequency as a function of the extent of homology between the targeting vector and the targeting locus. Mol. Cell. Biol., 1992, 12: 3365~3371 16 Sedivy J M, Joyner A L. Gene targeting, in gene targeting. Oxford University Press, 1992,77~122 17 Hasty P, Ramirez-Solis R, Krumlauf Ret of subtle mutation into the Hox-2.6 locus in embryonic stem cells. Nature, 1991, 350: 243~246 18 Valancius V, Smithies O. Testing an in-out targeting procedure for making subtle genomic modifications in mouse embryonic stem cells. Mol. Cell. Biol., 1991, 11: 1402~1408 19 Askew G R, Doetschman T, Lingrel J B. Site-directed point mutations in embryonic stem cells: a gene-targeting tag-and-exchange strategy. Mol. Cell. Biol., 1993, 13: 4115~4124 20 Gu H, Zou Y R, Rajewsky K. Independent control of immunoglobulin switch recombination at individual switch regions evidence through Cre-loxP-mediated gene targeting. Cell, 1993, 73: 1155~1164 21 Abremski K, Hoess R, Sternberg N. Studies on the properties of P1 site-specific recombination: evidence for topologically unlinked products following recombination. Cell, 1983, 32: 1301~1311 22 Sauer B, Henderson N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proc. Natl. Acad. Sci. USA, 1988, 85: 5166~5170 23 Lakso M, Sauer B, Mosiugeset oncogene activiation by site-specific recombination intransonic mice. Proc. Natl. Acad. Sci. USA, 1992, 89: 6232~6236 24 Orban P C, Chui D, Marth J D. Tissue- and site-specific DNA recombination in transgenic mice. Proc. Natl. Acad. Sci. USA, 1992, 89: 6861~6865 25 Sauer B, Whealy M, Robbins Aet -specific insertion of DNA into a pseudorabies virus vector. Proc. Natl. Acad. Sci. USA, 1987, 84: 9108~9112 26 Lakso M, Pichel J G, Gorman J Ret vivomanipulation of mouse genomic sequences at the zygote stage. Proc. Natl. Acad. Sci. USA, 1996, 93: 5860~5868 27 Thomas K R, Capecchi M R. Introduction of homologous DNA into mammalian cells induces mutations in the cognate gene. Nature, 1986, 163: 34~38 28 Song K Y, Schwartz F, Maeda N,et modification of a chromosomal plasmid by homologous recombination in human cells. Proc. Natl. Acad. Sci. USA, 1987, 84: 6820~6824 29 Lin F-L, Sperle K, Sternberg N. Recombination in mouse L cells between DNA introduced into cells and homologous chromosomal sequences. Proc. Natl. Acad. Sci. USA, 1985, 82: 1391~1395 30 Doetschman T, Gregg R G, Maeda Net correction of a mutant Hprt gene in mouse embryonic stem cells. Nature, 1987, 330: 576~578 31 Thomas K R, Capecchi M R. Site-directed mutagenesis by gene targeting in mouse embryonic stem cells. Cell, 1987, 51: 503~512 32 Reid,L.H, Gregg,R.G, Smithies,Oet elements in the introns of the human Hprt gene are necessary for its expression in embryonic stem cells. Proc. Natl. Acad. Sci. USA, 1987, 87: 4299~4303 33 Bertling W M, Gene targeting, in gene targeting. Manual, A. ,Ed. CRC Press, 1995, 1~44 34 Smithise O, Gregg R G, Boggs S Set of DNA sequences into the human chromosomal β-globin locus by homologous recombination. Nature, 1985, 317: 230~234 35 Thomas K R, Folger K R, Capecchi M R. High frequency targeting of genes to specific sites in the mammalian genome. Cell, 1986, 44: 419~428
本文原创来源:电气TV网,欢迎收藏本网址,收藏不迷路哦!





添加新评论